Veeva Vault Product Surveillance
Vault Product Surveillance simplifica y estandariza el seguimiento posterior a la comercialización de dispositivos médicos, mejora la seguridad, confiabilidad y calidad del producto. La automatización completa de los sometimientos electrónicos ante la autoridad sanitaria, así como la salida de sometimientos físicos, garantiza el reporte puntual de eventos adversos. Su fluida conexión con los procesos regulatorios y de calidad facilita el manejo proactivo de quejas, lo que acelera la innovación continua a lo largo del ciclo de vida del producto.
Beneficios
Mejora la calidad del producto y la seguridad del paciente
Identifica y resuelve proactivamente los problemas relacionados con la calidad del producto para obtener mayor confianza, seguridad y cumplimiento.
Garantiza la puntualidad de los sometimientos
Cumple los plazos de los sometimientos mediante un árbol de decisión para notificaciones globales global con criterios específicos para cada país.
Visibilidad en tiempo real y control de principio a fin
Toma decisiones comerciales informadas mediante la visualización en tiempo real de los sometimientos y los parámetros de cumplimiento de normativas.
Característica
Árbol de decisión para notificaciones globales
Estandariza y consolida los procesos de notificaciones de quejas para las diversas autoridades sanitarias a través de un árbol de decisión general.
Gestión de plazos de reportes
Gestiona de manera eficiente los plazos de reportes específicos para cada evento con el fin de garantizar el cumplimiento de normativas y la puntualidad ante varias autoridades sanitarias. Permite a los equipos regulatorios y de calidad asignar recursos y priorizar los sometimientos de manera efectiva.
Reporte automatizado de eventos adversos
La generación de carga XML integrada y la vía de intercambio electrónico de datos (EDI) brindan un sometimiento electrónico totalmente automatizado para los reportes electrónicos sobre dispositivos médicos de la FDA (eMDR). Además, admite el sometimiento físico de reportes incidentales del fabricante de la UE (MIR).
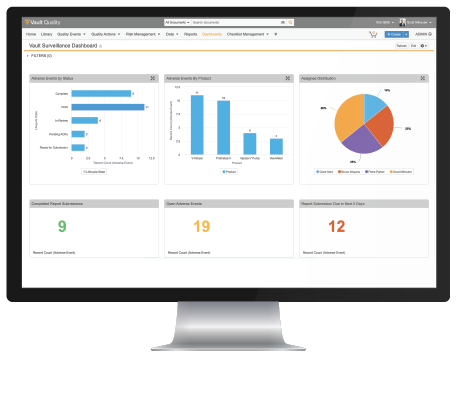
Dashboards y reportes interactivos
Los dashboards interactivos en tiempo real aportan claridad a las ineficiencias y obstáculos que provocan retrasos en la generación de reportes y el procesamiento. Actúa directamente desde la etapa de reportes para resolver problemas y finalizar tareas para acelerar el proceso de sometimiento.
Flujos de trabajo configurables de gestión de eventos
Automatiza y rastrea eventos mediante los flujos de trabajo estándar y configurables que asignan, enrutan, notifican por email, escalan y dan seguimiento a tareas de grupos o personas.
Parte de Veeva Vault Quality Suite
La conexión perfecta con Vault Quality Suite permite la gestión de la calidad de principio a fin, lo que mejora la calidad del producto y la seguridad del paciente. La unificación con los principales procesos de calidad, como la gestión de CAPA y la gestión de contenidos, elimina la necesidad de crear y mantener complejas integraciones entre sistemas.

