O Padrão CTD no Brasil
O CTD (Commom Technical Document) é o formato padronizado de organização do dossiê de registro e pós-registro de medicamentos dividindo-o em 5 módulos. Desde a publicação do Guia 24/2019, ainda que não mandatório, o padrão CTD pode ser considerado como implementado no Brasil.
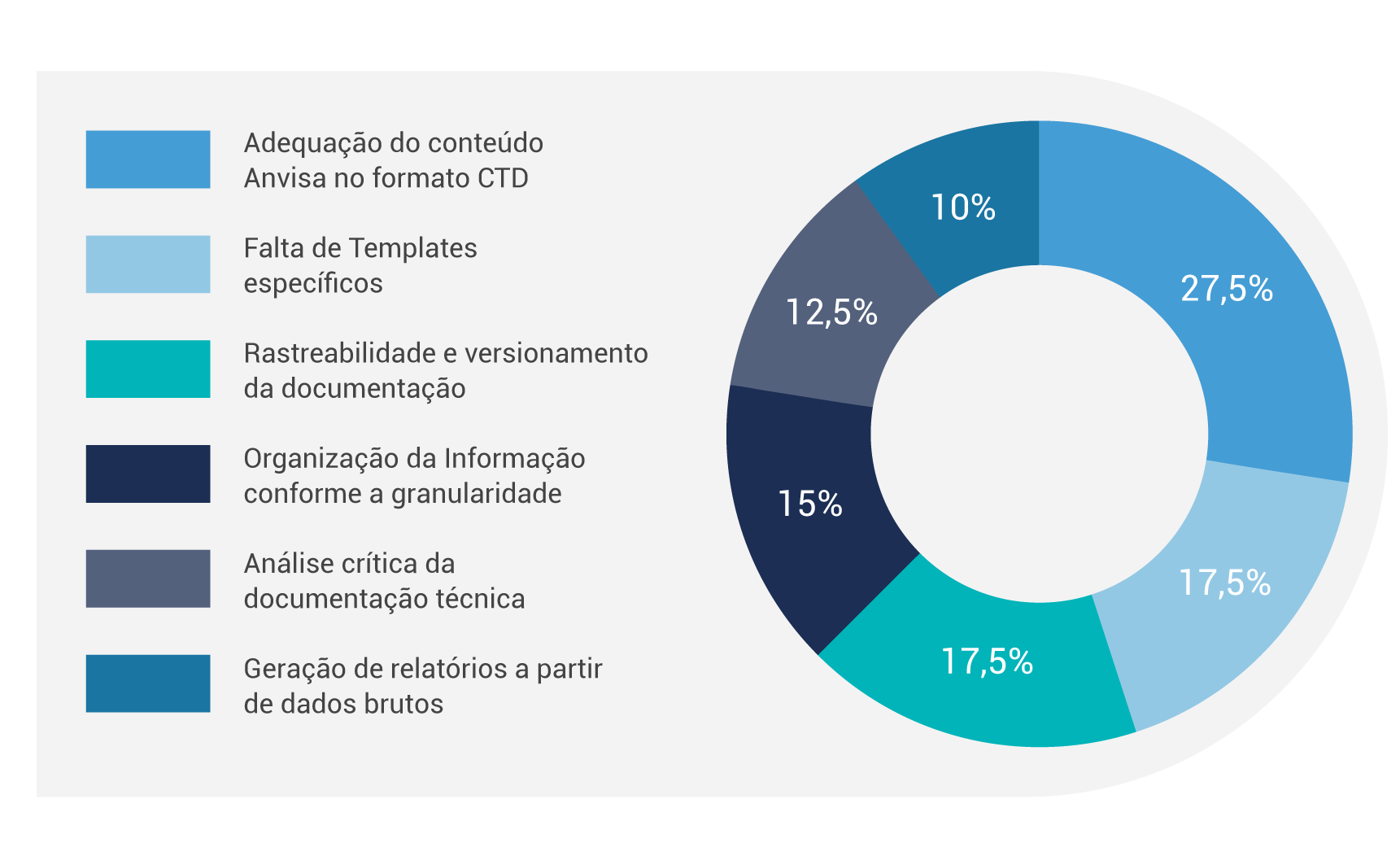
Para entender mais sobre esse momento de implementação do CTD no Brasil, a Veeva conduziu um estudo em parceria com a BrainLike Estratégia Regulatória que trouxe diversos insights do ponto de vista estratégico, técnico, operacional e administrativo.
Confira um desses insights no gráfico ao lado “Os principais desafios esperados na implementação do CTD no Brasil, na opinião dos participantes”:
Vault Submissions CTD Brasil
Para este momento a Veeva traz o Vault Submissions CTD Brasil, a solução completa de rápida implementação para adoção do padrão CTD nas submissões regulatórias.
Benefícios

Modelos de documentos pré-carregados para guiar a elaboração do Dossiê no padrão CTD

Monitoramento completo do desenvolvimento do Dossiê

Possibilita a revisões e aprovações de documentos de forma organizada

Biblioteca com todos os documentos utilizados salvos e com fácil rastreabilidade
FAQ
Parceria Veeva
Uma vez implementado, o Vault pode ser facilmente expandido para cada um dos processos Regulatórios da Suite Vault RIM.




A Veeva quer ser a sua parceira estratégica neste momento de transformação.

Vamos conversar?
Entre em contato com o nosso time comercial através do e-mail antonio.faggioni@veeva.com ou pelo telefone +55 11 99221-7177.

