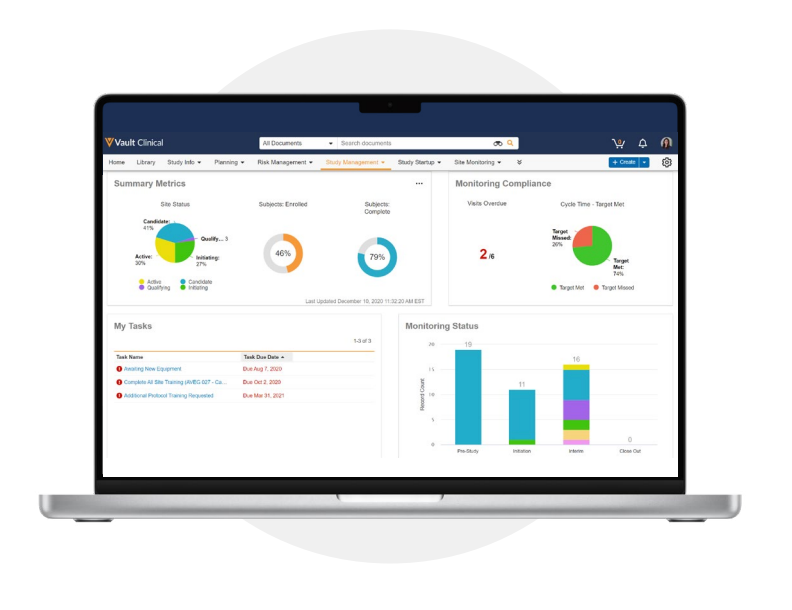
최신 CTMS로 구현하는 포괄적인 임상시험 관리
Veeva CTMS는 임상시험 관리를 간소화하고, 포트폴리오 전반에 걸쳐 완벽한 가시성을 확보하며, 자체 운영 및 아웃소싱 임상시험의 연구를 위한 임상 정보와 프로세스를 통합하는 유일하게 유연한 클라우드 애플리케이션입니다.
스터디 팀은 단일의 통합된 보안 시스템 내에서 임상시험의 포괄적인 전체 프로세스를 관리하고 전 세계적인 업무 현황을 파악할 수 있습니다. Veeva CTMS는 간결한 탐색 기능과 임상 마스터 데이터 및 연구 정보에 대한 단일 정보원을 제공하여, 운영 효율성을 개선하고 더 빠르고 높은 품질의 임상시험 실행을 가능하게 합니다. 조직의 고유한 임상시험 니즈, 연구 설계, 치료 영역, 그리고 비즈니스 프로세스에 쉽게 적응하는 유연하고 민첩한 솔루션으로 운영을 간소화하십시오.
주요 비즈니스 효과
-
생산성 향상 및 비용 절감
모니터링 계획 및 실행을 간소화하여 효율성을 높이고, 소요 시간을 30% 이상 단축하며 임상시험 비용을 절감하십시오. -
의사 결정 개선
단일 시스템에서 글로벌 운영 현황을 완전히 파악할 수 있어 전략적인 임상시험 계획 수립이 더욱 쉬워집니다. 단일 통합 시스템에서 활동을 능동적으로 관리하고, 주요 성과 지표를 추적하며, 지연을 완화하여 임상시험 실행을 최적화하십시오. -
스폰서와 CRO간의 협업 강화
포트폴리오 성과를 모니터링하여 동향을 파악하고, 영향력 있는 논의를 이끌어내며, 선제적인 액션을 취할 수 있도록 지원합니다.
단일 정보원
Veeva Clinical Operations를 통해 스터디 팀은 싱글 사인온(Single Sign-On) 으로 일관된 경험을 누리고, 여러 시스템을 끊임없이 전환하는 불편함을 피할 수 있습니다. 임상시험 정보와 문서를 한 번만 제출하고 다양한 시스템, 임상시험 사이트, 그리고 국가에서 활용하십시오. 이러한 단일 정보원 확보는 가시성과 통제력을 개선하여 임상시험 실행을 가속화합니다.
-
연구 계획 및 관리
자체 운영, 아웃소싱, 그리고 기타 임상시험 형태 전반에 걸쳐 연구의 주요 단계를 계획하고 추적하여 자원 활용을 최적화하십시오. 또한, 임상 물품 도착 시점을 사이트 개시 방문과 맞추거나, 여러 연구에 걸친 사이트 성과를 평가하는 등 선제적인 이벤트 계획을 수립하십시오. Veeva CTMS는 임상시험 계획서(Protocol), 방문 빈도, 그리고 절차 등 카테고리에 기반하여 원활한 대상자 방문 계획 수립을 지원합니다. -
이슈 관리
임상시험계획서 위반(Protocol Deviation), 문제 사항(Issues), 후속 조치 항목을 모든 임상시험에 걸쳐 쉽게 기록, 추적, 관리하십시오. 필요한 액션을 신속하게 식별하고, 임상 업무 상태를 평가하며, 문서 품질 문제를 기록하여 폐쇄형(Closed-Loop) 문제 관리를 지원합니다. -
스터디 관리 감독
연구 성과를 모니터링하고, 연구 전반에 걸쳐 대상자의 진행 상황을 보고하며, CRO 활동을 추적하고, 커뮤니케이션 기록을 유지하여 ICH/GCP 가이드라인 준수를 보장하도록 지원합니다. 임상 연구 담당자(CRA)는 또한 효과적인 이슈 관리를 위해 임상시험계획서 위반(protocol deviation)을 기록 및 추적할 수 있습니다. CTMS Transfer은 스폰서와 CRO 간의 원활한 데이터 교환을 가능하게 하여 감독 업무를 용이하게 합니다. -
대상자 모집 계획
연구 내에서 스크리닝, 등록, 또는 무작위 배정될 대상자의 수를 계획하고, 이를 연구 전체, 연구 국가, 그리고 임상시험 사이트 수준에서 종합적으로 파악하십시오. 실제 모집 데이터로 업데이트되는 지표를 통해, 목표 대비 대상자 등록 현황을 추적하여 임상시험이 일정에 맞게 진행되도록 보장할 수 있습니다. -
연구자 관계 관리
스폰서, CRO, 임상 연구자, 그리고 임상시험 사이트 직원 간의 상호작용에 대한 정확하고 완전한 뷰를 스터디 팀에게 제공하십시오. 사이트 커뮤니케이션 기록, 사이트 모니터링 방문, 사이트에 할당된 자원 등 다양한 정보를 추적하여 협업을 강화하고 임상시험 실행을 개선하십시오. -
스터디 관리 감독
연구 성과를 모니터링하고, 연구 전반에 걸쳐 대상자의 진행 상황을 보고하며, CRO 활동을 추적하고, 커뮤니케이션 기록을 유지하여 ICH/GCP 가이드라인 준수를 보장하도록 지원합니다. 임상 연구 담당자(CRA)는 또한 효과적인 이슈 관리를 위해 임상시험계획서 위반(protocol deviation)을 기록 및 추적할 수 있습니다. CTMS Transfer은 스폰서와 CRO 간의 원활한 데이터 교환을 가능하게 하여 감독 업무를 용이하게 합니다. -
시험기관 모니터
Veeva CTMS 내에서 임상시험 전, 사이트 개시, 중간 모니터링, 시험 종료를 포함한 모든 일상적인 모니터링 방문 활동을 관리하십시오. 임상 연구 담당자(CRA)는 임상 연구 담당자(CRA) 홈페이지에서 등록 지표 및 위반 사항과 같은 핵심 정보를 한눈에 확인할 수 있으며, 새로운 모니터링 방문 보고서를 신속하게 작성하고, 현장 모니터링 활동을 단일 애플리케이션 내에서 추적할 수 있습니다. -
위험 기반 스터디 관리
환경설정 가능한 위험 평가를 통해 운영 위험을 줄이고 데이터 품질을 향상시키십시오. 중요 데이터와 프로세스를 정의하고, 위험 점수를 계산하며, 완화 조치를 실행하여 임상시험의 핵심 영역에 집중하고 일정을 유지하도록 하십시오. -
Clinical Operations에서 EDC Connection으로
데이터 중복 입력 및 전사 오류를 제거하고 모든 시험기관의 등록 상태에 대한 실시간 가시성을 제공합니다. 연구 관리자와 임상 연구 담당자(CRA)는 별도의 로그인 없이 Veeva CTMS의 피험자 또는 피험자 방문에서 Veeva EDC의 해당 사례 및 폼으로 원활하게 이동할 수 있습니다. -
시험기관 비용 지급
Veeva CTMS와 통합된 Veeva Payments는 임상 연구 사이트에 대한 비용 지급 속도를 높이고, 연구 예산을 추적하며, 지급 상태에 대한 투명성을 제공합니다. 복잡한 임상시험을 지원하도록 설계된 Veeva Payments는 스폰서와 CRO가 임상시험 사이트에 더 빠르고 정확하게 비용을 지급할 수 있도록 지원합니다. -
Clinical Operations에서 CRM Connection으로
Veeva Clinical Operations의 스터디 팀과 CRM의 의학학술교류자(MSL) 간에 의료 전문가(HCP) 관련 활동 정보를 전송하여, 협력, 효율성, 그리고 투명성을 개선하십시오.
Veeva Clinical Operations 소개
Veeva Clinical Operations는 단일 통합 플랫폼을 통해 임상 팀의 효율적인 임상시험 실행을 지원합니다. 임상시험 스타트업부터 종료까지 프로세스를 간소화하고 데이터 가시성을 개선함으로써, 스폰서, 임상시험 사이트, CRO 간의 협업을 강화하고 일정을 가속화합니다.
