문서구조와 분류체계의 고민, Veeva Quality Content Reference Model로 해결하세요.
“타사는 어떻게 GMP 문서를 관리하고 있나요?” 고객 미팅을 할 때 가장 많이 듣는 질문입니다. 신생업체들로부터 업계에서 몇 십년 이상 사업을 운영해 온 장수 기업에 이르기까지 모두가 가지고 있는 공통적인 질문입니다. 왜 다들 서로를 궁금해 할까요?
‘문서로 시작해서 문서로 끝난다’고 흔히 이야기하는 GMP (Good Manufacturing Practice) 영역에서 문서의 계층 구조와 분류 체계를 표준화하거나 세부적으로 정의한 규정은 없습니다. 물론 기준서, 절차서(SOP), 기록서 등 GMP 준수를 위해 필요한 문서는 규정되어 있지만 제약업체 별로 제품, 인프라 및 추구하는 품질의 수준이 다르기 때문에 일괄적으로 세부 사항까지 규정하지 않았습니다. 심지어 WHO GMP에서는 문서류의 체제 및 운용방법은 제조업자의 재량에 따른다고 정의한 바 있습니다.1
그래서 많은 제약업체는 GMP 규정을 준수하면서도 업무 효율을 극대화할 수 있도록 각 조직에게 적합한 문서의 계층구조와 분류체계를 수립하고 운영하기 위해 많은 시간과 노력을 투자합니다. 그럼에도 불구하고 이러한 노력의 결과물이 해당 기업에게 최적화되어 있는지, 추가적인 개선 사항이 있을지 늘 타사의 사례를 통해 확인하고 싶어합니다.
Veeva에서도 마찬가지로 제약업체들에게 참고 자료를 지원하기 위한 고민을 해오고 있었고, 드디어 Veeva 품질 컨텐츠 참조 모델 (Veeva Quality Content Reference Model, 이하 참조 모델) 을 제시할 수 있게 되었습니다. 참조 모델은 전 세계 300건이 넘는 Veeva의 고객 사례 및 제언을 바탕으로 구성하였으며, 전반적으로문서 계층구조, 계층구조 별 문서유형 및 문서 생애주기를 설명하고 있습니다. 세부적으로는 문서유형 별 문서 생애주기는 물론이고 문서와 함께 관리해야 하는 메타데이터 정보 또한 규정하였습니다.
Veeva는 참조 모델을 통해 제약업체들이 규정준수를 위한 문서를 손쉽게 선정하고, 문서관리자 및 사용자 간의 의사소통을 개선하고, 이를 통해 보다 효율적인 업무절차를 수립할 수 있을 것으로 기대하고 있습니다. 또한 시스템 도입시 관리대상을 선정하거나 과거 문서의 이관 (migration) 범위를 선정하는 등 보다 신속하게 시스템을 구축하고 안정화할 수 있을 것입니다. 추가적으로 참조 모델을 통해 위탁생산업체 등 외부 업체와의 소통이 원활해지며 전반적인 비즈니스의 효율성이 개선되기를 바랍니다.
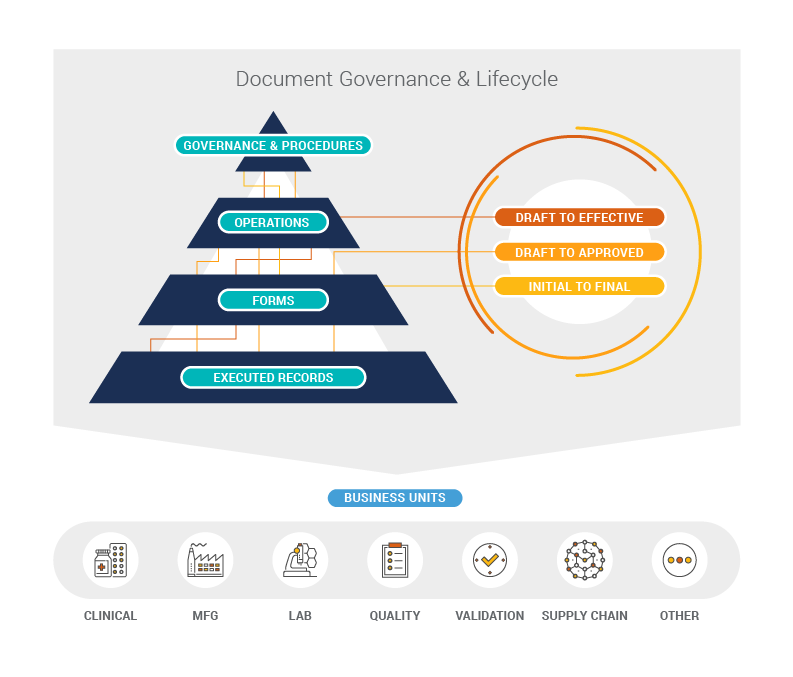
여기에 더해 GMP 뿐만 아니라 제품의 생애주기에 따른 GxP의 모든 영역에서 본 참조 모델을 활용할 수 있을 것으로도 기대하고 있습니다. 그래서 개발, 임상 단계에서도 제조현장과 원활하게 소통하고, 또한 제조현장에서 사용하는 문서를 이해하고 미리 기술이전을 준비하는 등의 시너지가 있을 것으로 생각합니다.
참조 모델은 제품개발과 구축 및 구축 이후의 운영지원관리까지 포괄적인 서비스를 제공합니다. 이는 고객 성공을 회사의 가치로 여겨온 Veeva가 지속적으로 사용자의 피드백과 고민을 경청하고, 고객사가 비즈니스 전반에 걸쳐 고민하고 있는 어려움들을 지원할 수 있는 방안을 고심해온 성과입니다.
참조 모델에 자세한 사항은 본 페이지 에서 확인하실 수 있습니다. 많은 고민과 검토 끝에 구축한 참고모델이라 할지라도 모든 제약업체들이 직면한 상황에 적용하기에는 많은 개선사항이 있을 것으로 생각됩니다. 본 참조 모델이 보다 다양한 제조업체들에게 도움될 수 있도록 여러분들의 많은 의견과 제안을 기다리고 있습니다. (제품 및 서비스 문의: kr_info@veeva.com)
2021년 6월
Veeva Systems
Quality Strategy – Korea
부장 이정환
1 WHO GMP Annex 3. (중략) The design and use of documents depend upon the manufacturer. (후략)
