Veeva Registrations
변화하는 규제 요건에
보조 맞추기
글로벌 제품 등록 및 관련 변경 사항을 추적합니다.
Announced 2015
Status MATURE
Customers 100+
Veeva Registrations를 통해 임상시험 의뢰기관은 보건 당국 서신 및 약정에 따라 글로벌 제품 등록을 계획, 추적 및 보고할 수 있습니다.
Events는 제안된 변경 사항의 초기 평가부터 규제기관 문서 제출 생성, 보건 당국 상호 교류 및 최종 등록 업데이트에 이르기까지 제품 변경을 관리하는 기능을 제공합니다.
라벨 변경은 글로벌 및 로컬 수준에서 추적 관리할 수 있습니다. 또한, Veeva Registrations는 EU 규정에 대한 컴플라이언스 제품 데이터 출력(예: xEVMPD 및 IDMP)을 생성합니다.
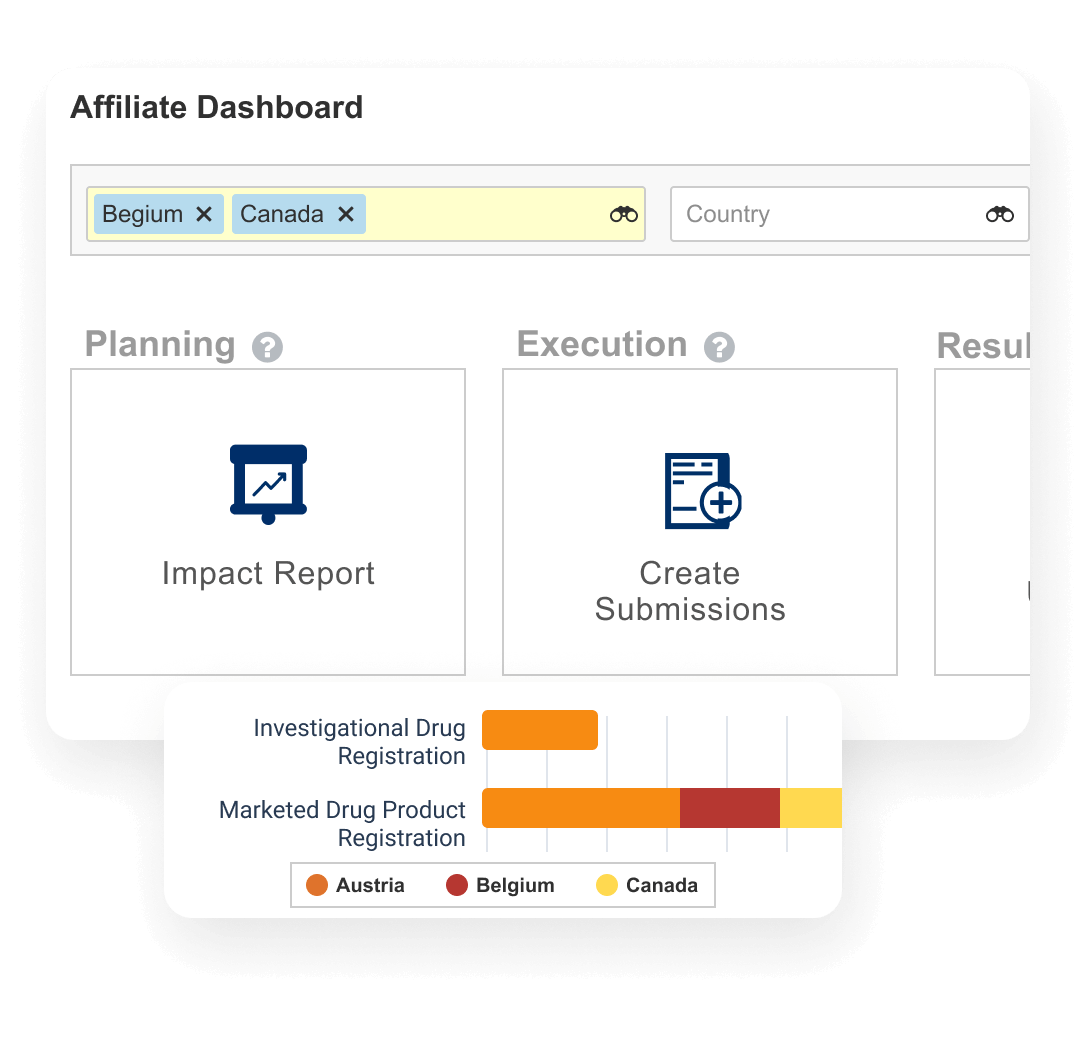
대시보드 및 리포트를 통해 변경 이벤트의 진행 상황을 추적하고 제품 등록 지역을 파악할 수 있습니다.
Veeva Registrations를 선택해야 하는 이유
제품 등록 계획, 추적 및 보고
데이터 품질 개선
데이터 중복 및 불일치를 줄여 등록 관리를 간소화합니다.글로벌 가시성 제공
글로벌 제품 포트폴리오의 마케팅 상태를 완벽하게 파악하여 정보를 최신으로 유지합니다.보건 당국의 대응 속도 향상
제품 등록 질의 및 약정을 관리하여 응답 마감일을 미리 파악합니다.
예상 결과를 뛰어넘는
성과 달성
성과 달성
15
상위 20개 기업 중 Veeva RIM을 사용하는 기업 수
88
하나로 통합된 IT 시스템 수
90%
서면 기준서(standard) 감소











