새해, 임상시험을 재개할 준비가 되셨나요?
COVID-19 팬데믹이 확산되는 가운데 완화된 규제와 이의 국가적, 지역적인 확장이 점점 익숙해지고 있습니다. 거리두기 조치에도 차차 적응하게 되었으며, 많은 임상시험의뢰자는 진행이 중단되었던 임상시험의 재개를 검토하고 있습니다.
재개된 임상시험, 진행 중인 임상시험, 새로운 임상시험 모두, 방문이나 평가 및 특정 데이터의 누락 문제를 해결하기 위해서 데이터 수집 과정의 처리와 관리에 대해 충분히 검토해야 합니다. 아래에서 그 방법을 설명합니다.
주요 고려사항
최종적으로 데이터는 임상시험 완료 이후 분석에 사용됩니다. EMA와 FDA는 가이드라인을 발행하여, 모든 데이터의 수집과 제출에 대해 강조하고 있으며, 데이터 누락의 경우는 누락 사유를 포함하여 설명하도록 합니다.
FDAa: ‘’임상시험계획서에서 지정하는 정보가 누락된 경우(예: 시험 방문 누락 또는 COVID-19로 인한 연구 중단)에는 COVID-19 상황과의 관련성을 포함하여, 누락된 데이터의 근거를 설명하는 정보를 증례기록서에서 수집하는 것이 중요하다.’’.
EMAb: ‘’위험성 평가는 임상시험 수행 관점에서 데이터의 품질과 신뢰성에 중점을 두어야 하며, COVID-19 팬데믹으로 인해 발생한 사건(예: 치료 중단)과 데이터 누락이 데이터의 분석과 해석에 미치는 영향을 고려해야 한다.’’.
또한 임상시험계획서의 설계와 변경 필요 여부를 검토하는 것도 도움이 될 수 있습니다. 예를 들어, 탐색적 평가변수와 관련된 데이터 수집의 중단 여부를 검토할 수 있습니다. 이를 통해, 시험기관 전문가와 연구진의 부담을 줄이고 환자의 위험을 경감할 수 있습니다.
상황의 진행에 맞춰 적응해 나가는 유연한 접근 방식이 필요합니다.
잠재적인 기술 과제
데이터 누락을 관리하고 시험을 중간에 변경할 수 있도록 전략을 정의할 때, 검토가 필요한 기술적 과제가 있습니다. 이러한 기술적 과제가 업계에 새로운 것은 아니지만 COVID-19로 인해 중요도가 높아졌습니다.
첫째, EDC 솔루션에서 시험기관이 데이터의 의도적 누락을 표시하는 간단한 기능을 제공하지 않는 경우, 부정적인 영향이 발생할 수 있습니다.
- 시험기관과 CRA가 추가적인 질의를 관리해야 합니다. 즉, 데이터가 의도적으로 누락된 것인지, 또는 입력이 지연된 것인지 상황을 확인하는 질의응답을 주고받아야 합니다.
- 의도적으로 비워 둔 데이터가 정확히 식별되지 않으면 데이터 완전성에 대한 운영 보고 내용이 왜곡될 수 있습니다.
- 스터디 디자이너는 누락된 데이터를 수집하기 위해 CRF를 추가로 마련하거나, 기존 양식 및 코드 목록에 COVID-19를 추가할 수도 있습니다. 이 방식은 시험기관의 문서 작성 완료를 위해 불필요한 양식이나 데이터를 추가하는 방법이므로 데이터 입력 시 비효율적입니다. 또한, 데이터 추출이 더 복잡해지기 때문에 임상시험 별로 변경이 필요할 수 있습니다.
둘째, 시험기관 인력의 부담을 줄이고 환자 위험을 줄이기 위해 임상시험계획서를 수정하는 것이 바람직할 수도 있지만, 기존 EDC 시스템에서 시험 도중에 변경되는 사항을 적용하려면 데이터 이관 및 정지(downtime)에 시간이 소요됩니다. 이 경우 임상시험계획서의 수정으로 얻는 이점보다 EDC 설계 변경에 소요되는 시간, 비용, 노력, 위험으로 잃는 것이 더 클 수 있습니다.
성공을 위한 전략
데이터 수집 전략의 관점에서 다음을 권장합니다.
- 수집해야 하는 핵심 데이터에 초점을 맞춥니다
- 누락된 데이터를 처리하는 표준 데이터 관리 지침을 문서화합니다
- 데이터 입력이 완료되지 않았거나 누락된 데이터를 표시하고 그 이유를 남길 수 있는 간단한 방법을 시험기관에 제공합니다
- 통계 분석을 위한 데이터세트 및 감사 추적 등에서 의도적으로 비워 둔 데이터를 쉽게 식별할 수 있도록 합니다
- 시험 도중에 변경사항을 적용할 수 있는 유연한 방식을 채택합니다. 신속한 도입을 위해 에자일 설계가 도움이 될 것입니다.
Veeva Vault EDC의 특장점
Veeva의 현대적인 클라우드 기반 EDC을 사용하면 시험기관에서 의도적으로 비워 둔 데이터, 양식, 방문을 쉽게 표시할 수 있으며, 그 이유를 데이터 입력 과정에서 간편하게 기록할 수 있습니다. 이를 통해, 데이터 검토자에게 더욱 정확한 페이지 누락 보고서를 제공할 수 있습니다. 또한, Veeva는 EDC 추출 데이터에 의도적인 빈 데이터 항목을 포함할 수 있으므로, 규제 기관이 권장하듯 영향을 받는 데이터의 정확한 양을 명확히 나타낼 수 있습니다.
중앙에서 관리하는 데이터 누락 원인의 드롭다운 메뉴 목록을 모든 임상시험에 적용할 수 있습니다. 개별 임상시험을 변경하거나 다시 검증하지 않고도 간단한 설정만으로 목록을 쉽게 업데이트할 수 있습니다. 예기치 못한 상황이 발생했을 때 새로운 이유를 쉽게 추가할 수 있으므로, 미래의 변수에도 효율적으로 대응하는 전략입니다.
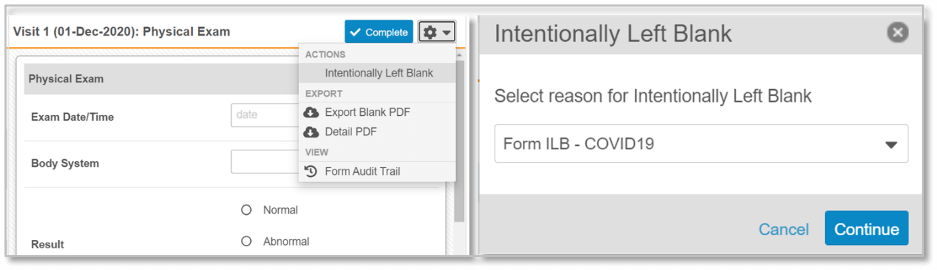
그림 1. 시험기관에서는 전체 이벤트, 양식, 또는 개별 데이터 필드가 의도적으로 비어 있도록 선택할 수 있습니다. 설정을 변경할 수 있는 드롭다운 메뉴 목록이 표시됩니다. 메뉴에서 선택한 누락 이유는 SDV, CDMS 보고, 데이터 추출 과정에서 명확하게 식별할 수 있습니다.
Vault EDC의 임상시험 수정은 신속하게 적용되며 데이터 이관이나 정지 시간(downtime)이 필요하지 않습니다. 특정 국가, 시험기관, 심지어 개별 환자에 대해서도 손쉽게 적용할 수 있습니다. 따라서 탐색적 평가변수 관련 데이터 수집을 중지하는 것과 같이 임상시험계획서 설계를 수정하려는 경우, EDC에서 간단하고 빠르게 변경 작업을 수행할 수 있습니다.
Veeva Vault EDC는 기업이 변화와 새로운 요구에 보다 빠르게 대응할 수 있도록 지원합니다. 자세한 내용은 veeva.com/kr/contact-us/를 통해 문의해 주십시오.
참고 문헌
a – FDA Guidance on Conduct of Clinical Trials of Medical Products during COVID-19 Public Health Emergency Guidance for Industry, Investigators, and Institutional Review Boards March 2020
b – EMA, Points to consider on implications of Coronavirus disease 5 (COVID-19) on methodological aspects of ongoing clinical 6 trials
