Veeva Submissions
薬事申請を効率化
Submissions は薬事文書の計画、作成、レビュー、承認に使用される最先端のコンテンツ管理アプリケーションです。申請に関連するあらゆる文書の作成、バージョン管理、承認、リアルタイムの共同編集のためのあらゆるエンタープライズ向け機能を提供します。コンテンツプランニング機能により、ユーザーが申請書類のアウトラインを構築すると、そのアウトラインに沿った文書が自動的に作成されます。
レポートレベルコンテンツプラン機能を使用すれば、臨床および非臨床レポートを作成してパブリッシュできます。ダッシュボードとレポートにより、申請担当マネージャーは各文書のステータスをリアルタイムで追跡することができます。
Announced 2013 Status Very Mature Customers 100+
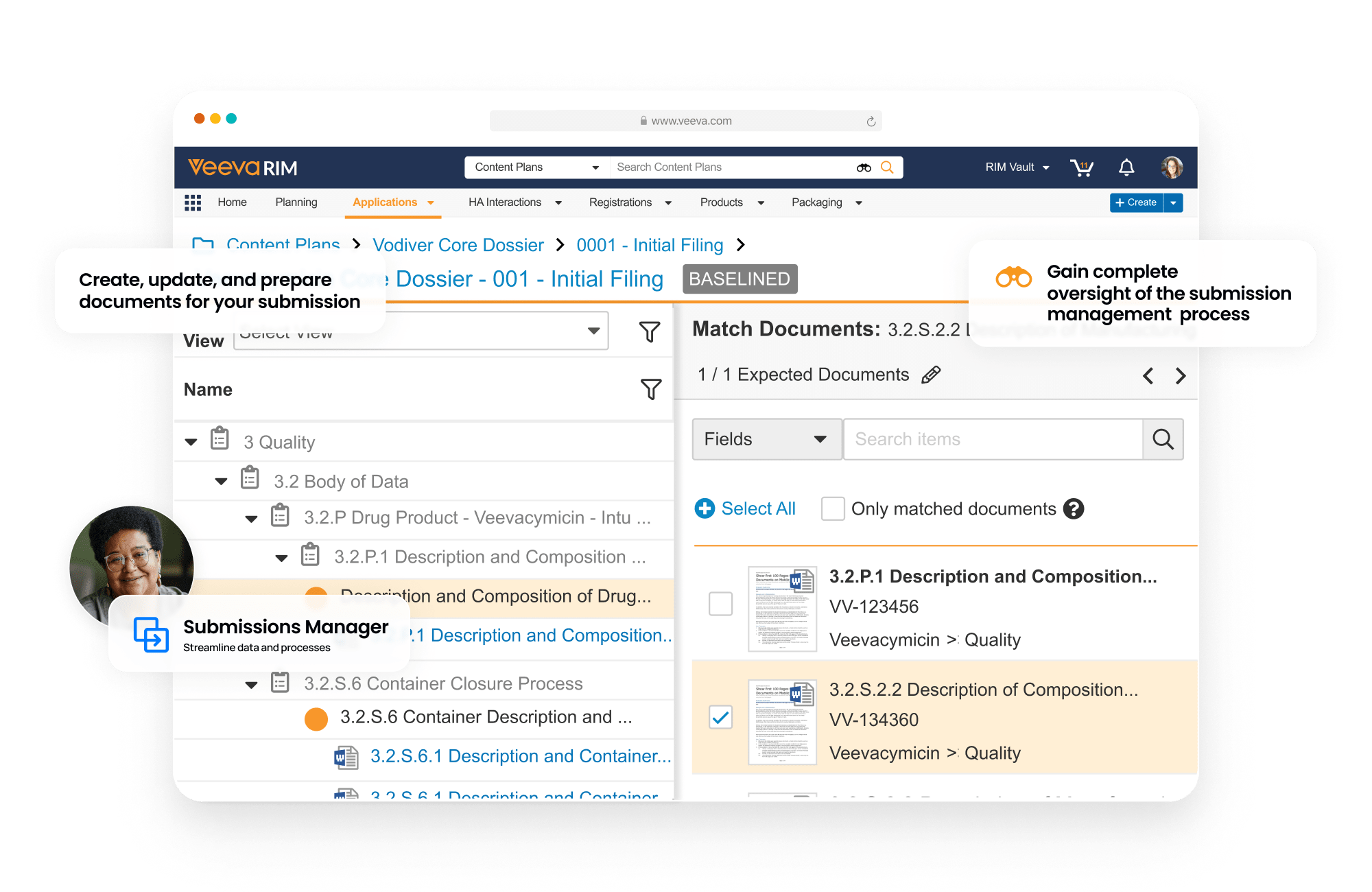
薬事部門がどのようにデジタル化を実現できるかについて詳しく見る
Impact
予想を超える成果を実現
15社
主要製薬企業 20 社中 Veeva RIM を使用している企業数
88件
Veeva の単一基盤で統合した IT システム数
90%
標準作業手順書の削減率
Why Veeva Submissions
信頼できる唯一の情報源
Customer Success
Veeva RIM は 400 社以上の主要製薬企業
およびバイオ医薬品企業に選ばれています