Veeva Vault Study Startup
臨床試験のスタートアップを迅速化
臨床試験の業務とプロセスを単一の使いやすい
アプリケーションに集約し、コストのかかる遅延を解消
Announced 2015
Status MATURE
Customers 11-50
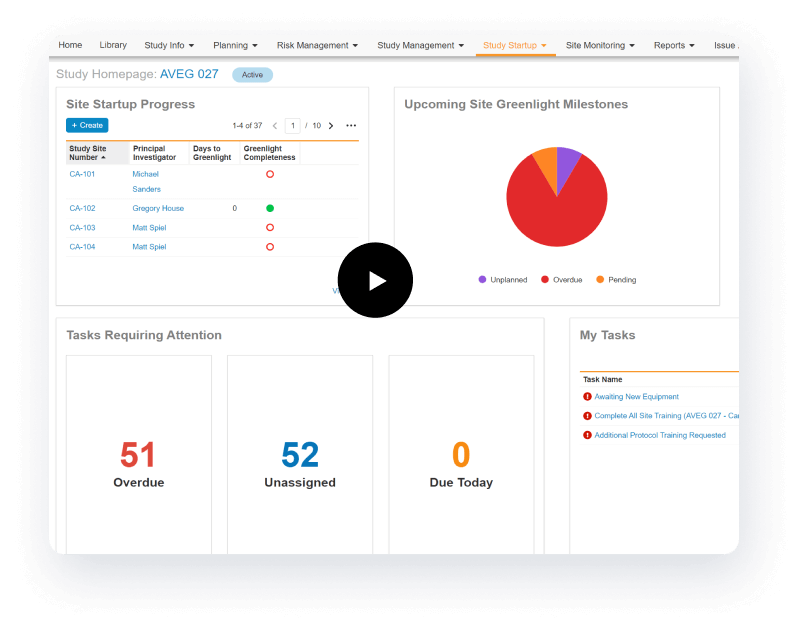
臨床試験のスタートアップを管理
Vault Study Startupは、治験実施医療機関の実施可能性調査、適格性審査、立ち上げを管理します。
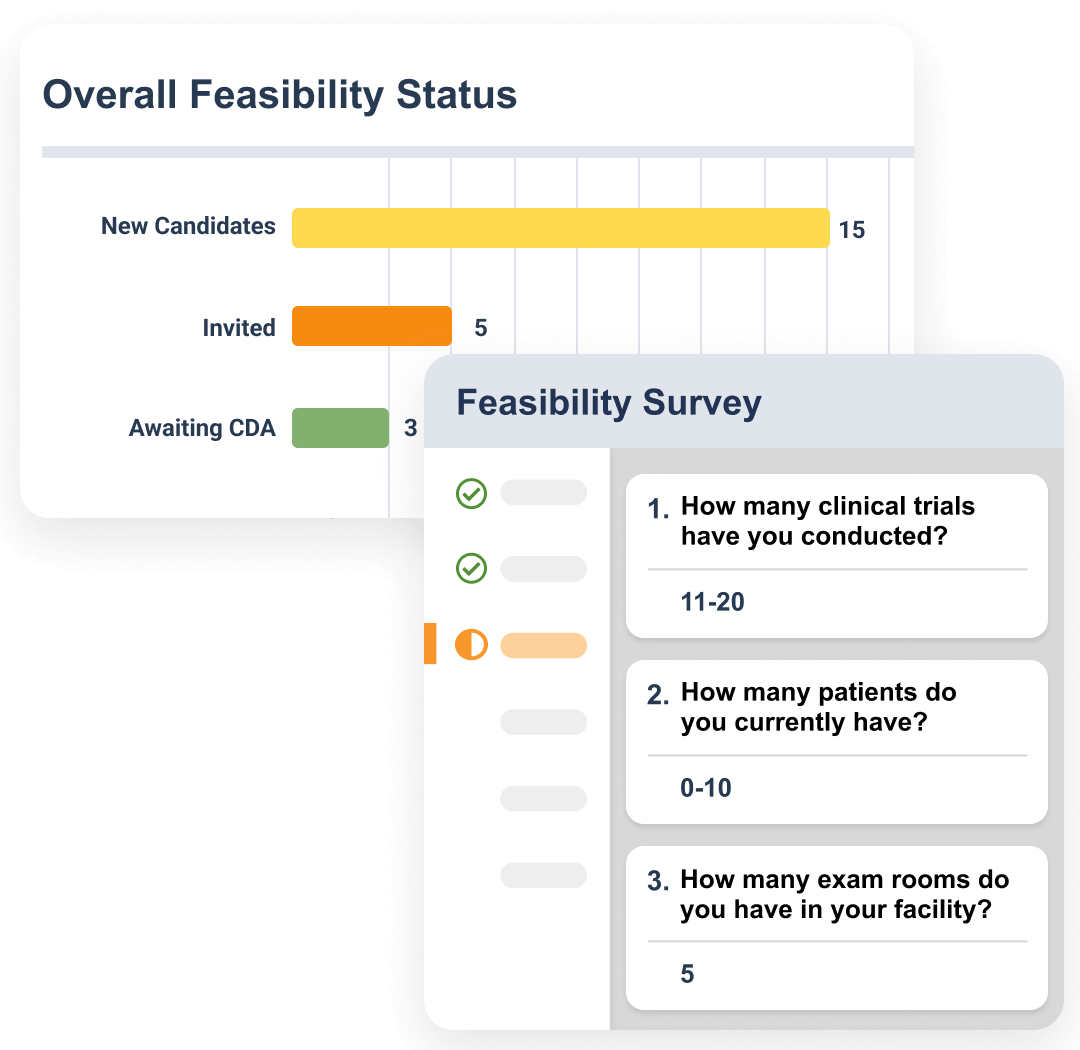
治験実施医療機関の選定を簡素化
治験実施医療機関の選定段階で、各機関に実施可能性調査表が送付されます。それらの機関は回答に基づいて自動的に採点され、選定されると立ち上げプロセスが開始されます。
治験実施医療機関のスタートアップを推進
Vault Study Startupは、治験実施医療機関の立ち上げを標準タスクとマイルストーンを通じて進めます。それらは、立ち上げの前に必要とされるプロセスと文書を明示した、国ごとに提供される柔軟なインテリジェンステンプレートを通じて管理されます。
完全な可視化を実現
ダッシュボードのビューで情報を収集、追跡、表示できるため、スタートアップの進展状況とタイムラインを把握できます。
Vault Study Startupが選ばれる理由
治験実施医療機関のスタートアップ時間を短縮
臨床試験のスタートアップを迅速化
治験実施医療機関の選定と実施可能性調査、倫理委員会の承認、治験実施医療機関との契約管理を効率化して、臨床試験をより迅速に実施できるようにします。効果的なコラボレーションを実現
臨床試験に関する情報をシームレスに交換してより的確な意思決定を行えるようにすることで、試験のパートナー間の連携を強化します。より多くの情報に基づくより的確な意思決定
自動化されたクリティカルパス管理により、知見を得て、依存関係やリスクのあるタスク、文書、マイルストーンの優先順位を付けることができます。
業務効率を向上
50%
治験実施医療機関の選定から被験者登録準備までの平均日数の短縮
45%
治験実施医療機関における最初の被験者登録までの期間の短縮
42%
プロトコルの承認から最初の被験者の登録までの期間の短縮