Veeva Registrations
製品登録の計画、追跡
およびレポート
Registrations により、スポンサーはグローバルな製品登録の計画、追跡、レポートと、規制当局とのやり取りやコミットメントの管理を行えます。
イベント機能を使用して、変更案の初回評価を終えてから提出書類を作成するまでに行われた製品の変更、規制当局とのやり取り、最終的な登録の更新を管理できます。ラベルの変更はグローバルでもローカルでも追跡・管理できます。また、Registrations は EU の規制に準拠する製品データ出力( xEVMPD および IDMP など)にも対応しています。
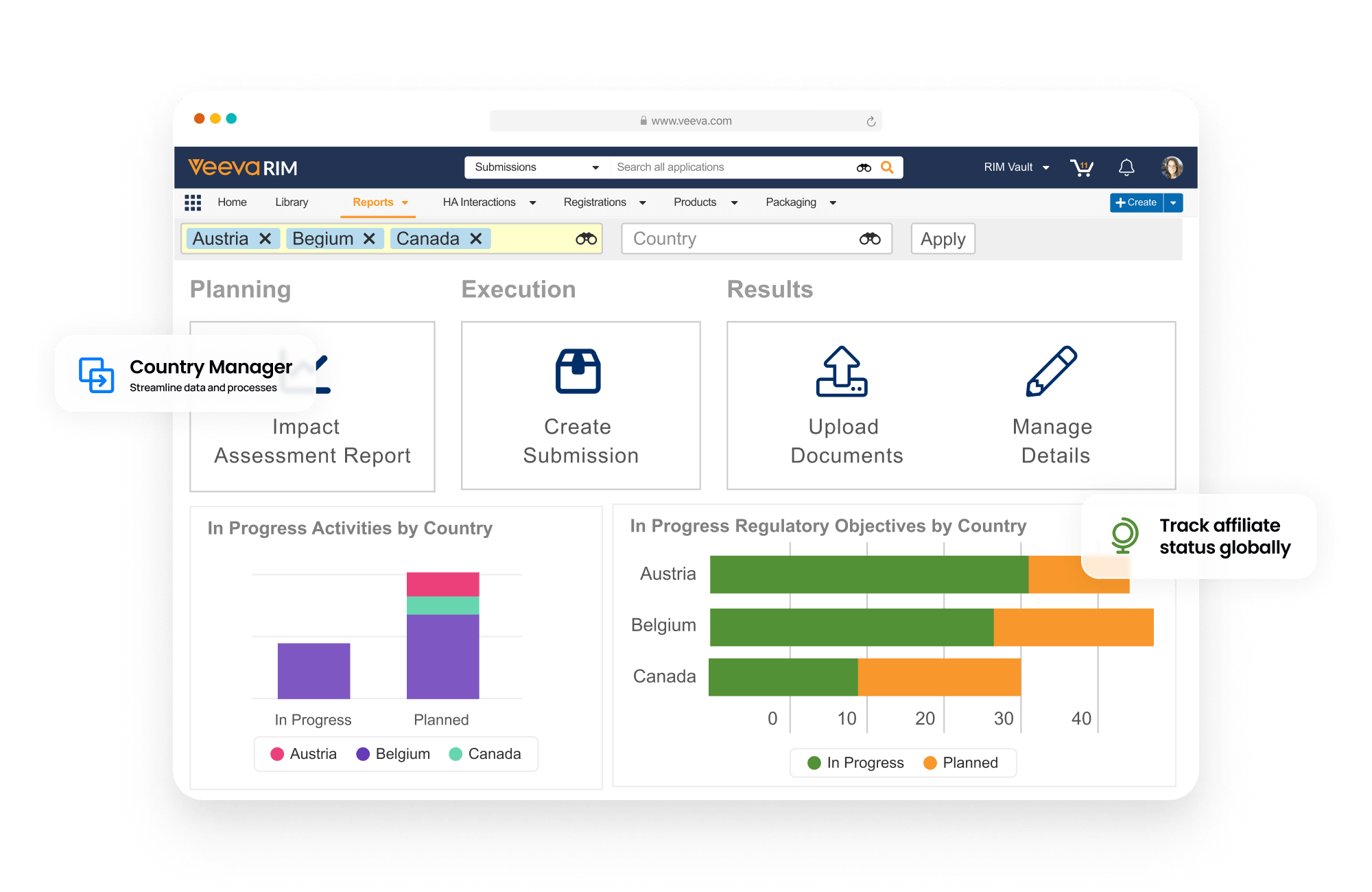
ダッシュボードとレポートにより、変更イベントの進捗状況を追跡し、各国の製品登録情報を把握できます。
Announced 2015 Status Mature Customers 100+
Veeva の柔軟なデータモデルが最新の IDMP 基準をどのように支援できるか見る
Impact
予想を超える成果を実現
15社
主要製薬企業 20 社中 Veeva RIM を使用している企業数
88件
Veeva の単一基盤で統合した IT システム数
90%
標準作業手順書の削減率
Why Veeva Registrations
製品登録の計画、追跡およびレポート
Customer Success
Veeva RIM は 400 社以上の主要製薬企業
およびバイオ医薬品企業に選ばれています














