ICH GCP E6 (R3) から読み解くオーバーサイト 後編
ICH E6 の歴史
ICH E6 は 1996 年に施行されましたが、 E6 初版では、責任医師や依頼者の責務やモニタリング報告書やアーカイブなどの Essential Document(必須文書) や IB(治験薬概要書) について定義され、そのあと 2016 年には E6 R2 が施行されました。多くの方は R2 の経験のほうが記憶に残っているかもしれませんが、品質マネジメントに加え「リスクに基づいたアプローチ」や QbD の概念が提唱されました。 R3 では、前回の Blog で触れたような構成の観点での変更点(「 Essential Document 」の章立てから別紙で「 Essential Records 」の章に更新)のほか、「 QbD の一部である CtQ (Critical to Quality) 」のような概念、またビジネス用語ではあるが治験の用語ではない筈の、「クリティカルシンキング( Ciritical thinking )」といった概念も入ってきています。当然 R2 から継続して、 Risk base の考え方やプロアクティブな活動といった概念も含まれています。
図:ICH E6 の歴史
resource: EMA ICH renovation overview

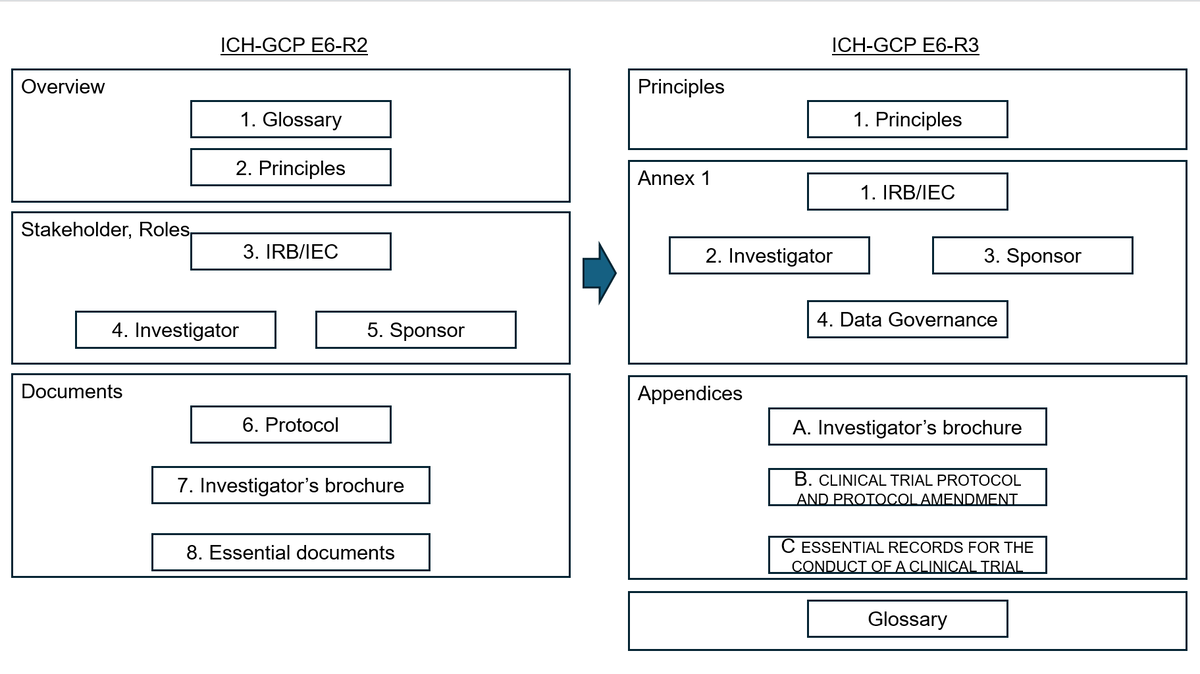
R2 から R3 への変更点
また R2 から R3 での構成変更をみてみると、「 Data Governance 」のほかいくつかデジタルテクノロジーの進化に伴い、詳細に記述されたものがあります。たとえば Appendices で定義されている「 ESSENTIAL RECORDS FOR THE CONDUCT OF A CLINICAL TRIAL 」も該当します。また複雑化する試験デザインに伴い、 Appendencies で「 CLINICAL TRIAL PROTOCOL AND PROTOCOL AMENDMENT 」も定義されていますし、より詳細に明文化されたのは Annex 1 の「 2. Investigator 」章などがあります。留意したいのは、 ICH はあくまでガイドラインで、共通の言語とフレームワークを提供するという位置づけであり、現場にどう落とすかの手法は記載されていない点です。
図: E6 R2 と R3 の構成比
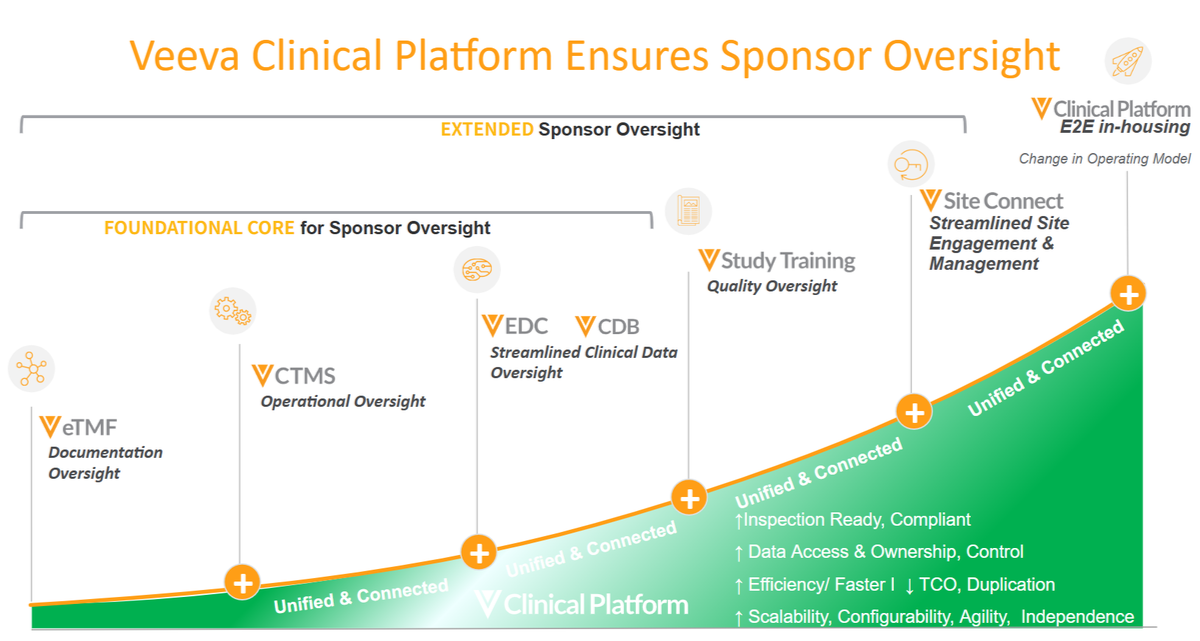
Veeva Clinical Operation 製品と ICH E6 ( R3 )
E6 ( R3 ) は今後、日本でもステップ 5 が公開されますが、 EU や US の動きを見る限り、テクノロジーの観点では、弊社製品で既に実装済みの機能で利用いただけるものが多く、またすでに、ご利用をいただいています。オーバーサイトの根幹となる、必須文書管理の Veeva eTMF と活動管理の Veeva CTMS では、 R3 の前からご提供している ” Risk-Based Study Management ( RBSM ) ”のほか、 25R2 リリースでご提供開始した eTMF の ” Risk-Based Document QC ” といった機能があります。また治験医師に求められる ” Qualifications and Training ” の対応を自動化する ” Veeva Study Training ” といった製品を提供しています。
もちろん厳格な手順書と運用で、テクノロジーを駆使しなくても R3 への対応は行うことは可能ですが、モニタリング活動のような「データ」のみを管理するか、モニタリング報告書のような「文書」のみを管理するかであり、両方を管理するシステムは他には類をみず、 ” Essential Records ” (必須文書+活動情報)を標準機能で実現できるのは、 Veeva eTMF / CTMS だけなのです。
図:オーバーサイトと弊社製品
依頼者向け Oversight Readiness Survey とは
Veeva では、E6 R3 への対応が十分か、依頼者さま向けの調査票「 Oversight Readiness Survey 」を無料提供しています。 Oversight Readiness Survey の目的は、 R3 規制要件への準備がどの程度できているか把握し、示唆を得ることです。
図:Oversight Readiness Survey構成

Survey は、「 Sponsor Oversight 」「 Data Governance 」「Qualification & Training 」「 Essential Record Management 」という 4 カテゴリに分かれており、約 70 の質問にお答えいただきます。Veeva Japan でも本 Survey への取り組みを開始しておりますので、ご関心のある方はぜひお問い合わせください。(対象は日本に拠点のある製薬会社様となります)
Veeva のクリニカルソリューションは、国内外の製薬企業様で広く活用されています。効果的なオーバーサイトのためのデジタル化や最適化についてお悩みの方は Veeva までお気軽にご相談ください。
